—— PROUCTS LIST
徠卡超高分辨顯微技術-病毒學相關研究應用
由于受到光學衍射極限的限制,普通光學顯微鏡分辨率只能達到200nm,而通常病毒和亞細胞結構的尺寸只有幾十到200多納米,遠遠小于普通光鏡的分辨率。超高分辨顯微技術的出現,為觀測這類精細結構提供了可能,因此也得到了越來越廣泛的應用。作為超高分辨技術的,受激發射損耗(STimulated Emission Depletion, STED)技術更是在生命科學領域尤其是病毒學相關研究中發揮著重要作用。
本次為大家分享STED技術在病毒學研究中的應用和新進展,助力生命科學研究和發展。
STED基本原理
2014年諾貝爾化學獎授予三位科學家,以表彰他們發明超高分辨顯微技術。其中Stefan Hell發明了STED技術,而徠卡公司也是*將其商業化。從2007年開始,徠卡STED產品不斷創新和優化,已經擁有近13年的STED技術積累。2014年*推出SP8 STED 3X,即榮獲當年的R&D100大獎。2019年更是創新性的推出了τ-STED,進一步在提升分辨率的同時降低了激光功率,更適合活細胞超高分辨成像。

2014年諾貝爾化學獎獲得者,左起分別是:Eric Betzig、Stefan W. Hell、William E. Moerner
說了這么多,STED技術原理到底是什么呢?很簡單。我們想象一下,一個點發射出的熒光信號,被檢測后通常是一個衍射斑;如果我們同時使用一個甜甜圈樣的激光將其周圍的信號擦除掉,只允許中心很小的熒光信號發射出來,這樣分辨率不就提高了嗎。這個起擦除作用的激光便是STED激光,也叫損耗光,利用的是熒光的受激發射損耗原理。之后,通過對圖像的掃描,即可直接呈現超高分辨圖像,無需任何后續計算過程。同時,根據公式,可通過增加STED激光功率來提升圖像分辨率。
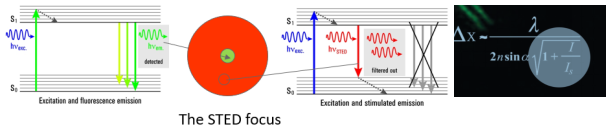 STED原理示意圖:STED通過受激發射損耗去除衍射環上的熒光信號,大大縮小有效的激發區域,從而改寫了分辨率公式,提高了光學分辨率
STED原理示意圖:STED通過受激發射損耗去除衍射環上的熒光信號,大大縮小有效的激發區域,從而改寫了分辨率公式,提高了光學分辨率
STED技術在病毒學研究中的應用實例
01
*應用實例,是對病毒精細結構的觀察。2012年發表在期刊science上,標題為:熒光納米顯微鏡(STED)揭示成熟依賴的HIV-1病毒表面蛋白的再分布特征【1】。
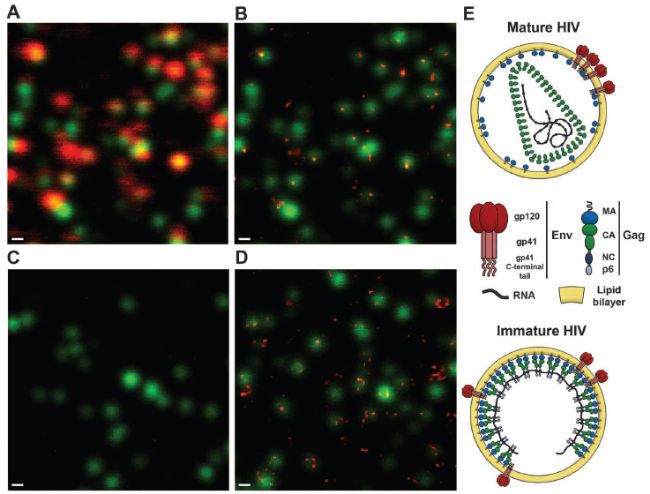
圖中綠色代表HIV-1病毒粒子,紅色表示病毒表面的膜蛋白。可以看到,通過普通共聚焦無法分辨膜蛋白的具體定位位置,很模糊。包膜糖蛋白gp120(紅色)與病毒粒子(綠色)90%共定位,信號模糊,分辨不出細節。而STED成像可以發現,大多數成熟病毒粒子表現出單一的包膜蛋白Env或焦點(圖1B),而大多數未成熟粒子表現出兩個或兩個以上的包膜蛋白Env(圖1D)。
02
第二個應用實例,是對病毒成熟過程的觀察。標題為:STED納米顯微鏡揭示HIV病毒蛋白水解成熟的時間過程【2】。
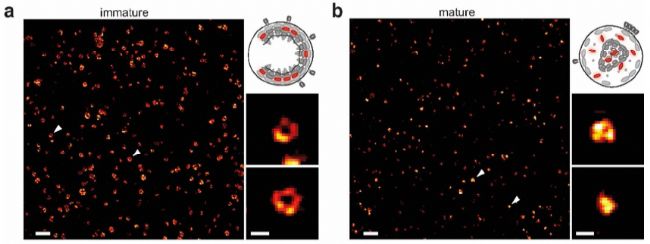
利用STED顯微鏡發現在HIV-1病毒成熟和未成熟條件下,可非常清晰區分其Gag蛋白的不同結構特征。未成熟病毒的Gag蛋白呈中空環狀(圖a),而成熟病毒中呈實心固縮狀(圖b)。

作者巧妙的利用光控方法,進行STED時間序列成像。在400nm紫外光照后,PDI(光催化降解的蛋白酶抑制劑)降解,Gag蛋白能夠被蛋白酶水解切割,進而病毒成熟。STED時間序列成像可輕松捕獲病毒從未成熟到成熟過程,Gag蛋白重排的結構變化過程。
03
第三個應用實例,是對病毒基因組示蹤。標題為:以單分子分辨率示蹤宿主細胞中的病毒基因組【3】。
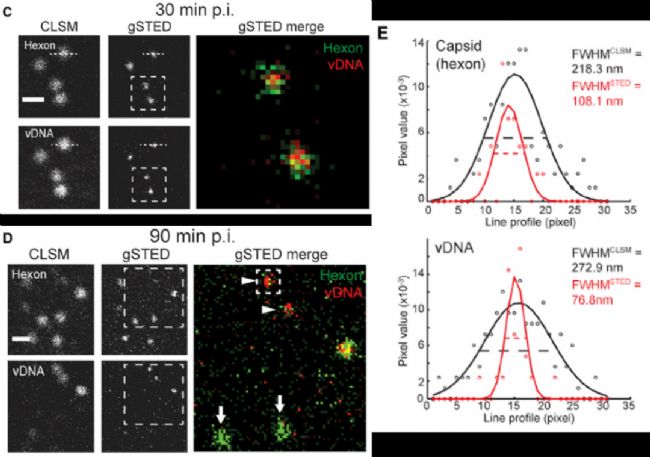
腺病毒DNA通過AF594標記的疊氮點擊反應顯示,衣殼蛋白通過抗hexon的抗體識別,并且只有在脫殼后,病毒DNA才可以被反應檢測到熒光信號。
通過gated STED超高分辨顯微成像,可顯著提高分辨率,清晰呈現病毒衣殼和DNA的真實尺寸大小。腺病毒衣殼實際大小約80nm,gSTED顯示約110nm(包含一二抗尺寸),與實際一致。gSTED顯示被衣殼蛋白包裹的病毒DNA尺寸略小于80nm,也與衣殼尺寸符合。
04
第四個應用實例,是對病毒基因組復制的觀察。標題為:利用STED超高分辨顯微鏡觀察復制的HSV-1病毒【4】。值得一提的是,本文由中科院昆明動物所周巨民老師課題組與徠卡公司合作完成。

病毒基因組復制是單純皰疹病毒 1 (HSV-1) 溶解感染周期的重要事件。目前由于檢測和觀察方法的局限,病毒復制過程的細節仍難以捕捉。為了獲得更加詳細的 HSV-1 復制機制,本文使用了STED受激發射損耗顯微鏡,結合熒光原位雜交 (FISH) 和免疫熒光,對HSV-1 復制過程進行了精細觀察。
作者設計了位于HSV-1病毒基因組兩端的探針,分別以DIG(綠色)和Biotin(紅色)進行標記,在病毒復制的早期和晚期,分別成像觀察。STED成像發現,在復制的早期,紅綠兩色信號的共定位程度較高;而在復制后期,兩個系數均發生了明顯降低,表明HSV-1 基因組在復制過程中經歷了從緊湊到松弛的動態結構變化,同時需要占用較大的空間進行復制。
05
第五個應用實例,是對病毒侵染和傳播過程捕獲的研究。標題為:ARP2和病毒誘導的絲狀偽足促進了人類呼吸道合胞體病毒的傳播【5】。
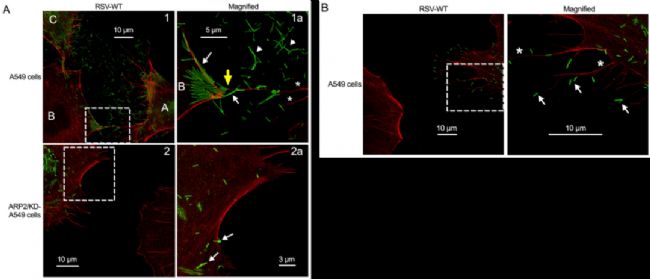
利用STED超高分辨顯微鏡進行成像,發現感染了RSV病毒的細胞(圖A首行,標記為A和C)外存在大量的絲狀偽足(紅色),且富集有大量病毒顆粒(綠色);暗示可通過絲狀偽足將RSV病毒傳遞給鄰近細胞。而在ARP2敲除的細胞中(圖A第二行),即便感染了RSV病毒,細胞的絲狀偽足數量都大量減少,病毒在細胞間的傳播不明顯。放大圖像(圖B),可觀察到RSV病毒主要分布在絲狀偽足的*,進一步驗證了病毒可通過誘導絲狀偽足的產生來促進其在細胞間的傳播。
如何進一步提高STED分辨率?
根據公式我們可以知道,通過增加STED激光功率就可直接增加圖像的分辨率,這個方法簡單;但問題是不利于活細胞成像。那么如何在不提高激光功率的前提下,進一步提高STED分辨率呢?有以下三種方法,分別是gated STED,gated STED + Lightning,和徠卡新推出的τ-STED。
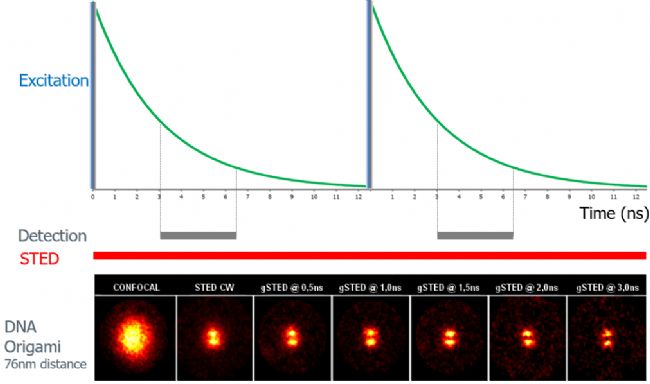
01
以兩個距離76nm的DNA Origami為例,gated STED在不改變STED激光功率的前提下,逐步縮小熒光壽命的檢測范圍,可逐步提高分辨率,清晰地分辨兩個點信號。
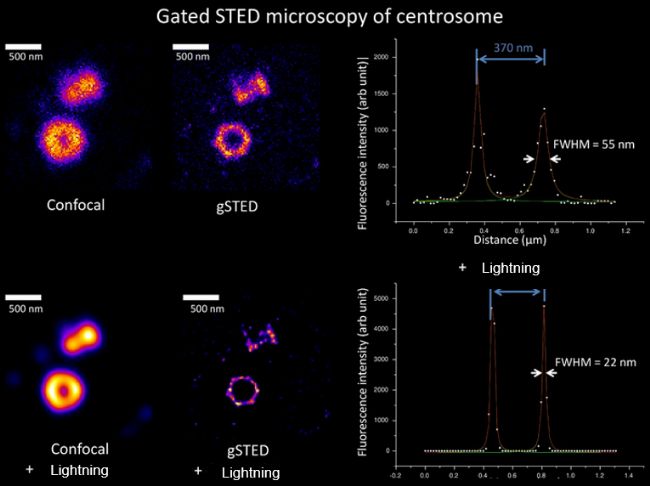
02
對中心粒的gated STED + Lightning成像結果,分辨率(半高寬)可達22nm!
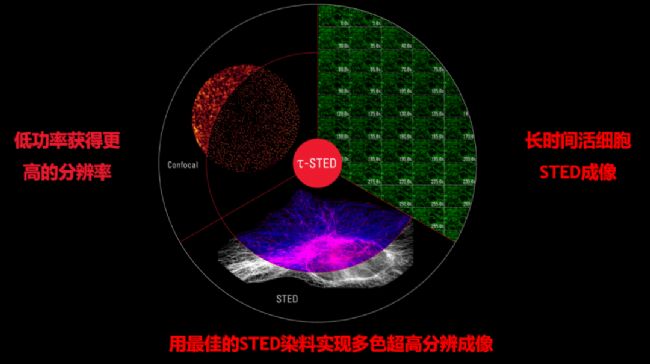
03
新一代STED:τ-STED,即將STED和超快速的熒光壽命相結合,實時呈現超高清分辨圖像。它在已有STED優勢的基礎上,可以更低激光功率獲得更高圖像分辨率,進一步拓展熒光染料的選擇,非常適合長時間的活細胞成像。
結語
徠卡STED擁有13年的研發、技術和服務經驗,也具有以下突出優勢特點,是病毒學研究的*利器:
“純光學"超高分辨顯微技術,所見即所得
全光譜、多色超高分辨成像,提供592nm/660nm/775nm三根 STED譜線
專為STED設計的多款滿足不同應用需求的物鏡
使用常規熒光染料及熒光蛋白,制樣簡單、方便
τ-STED低光毒性,更適合活細胞超高分辨成像
快速掃描頭能夠更好的保護樣品
LAS X Navigator能夠輕松尋找目標視野
此外,整個STED是搭載在徠卡共聚焦平臺上的,因此也擁有共聚焦的所有優點。相信徠卡STED超高分辨顯微鏡能夠更多地貢獻超高清圖像結果,助力病毒學和生命科學研究發展。
參考文獻:
【1】Chojnacki J, Staudt T, Glass B, et al. Maturation-dependent HIV-1 surface protein redistribution revealed by fluorescence nanoscopy.[J]. Science, 2012, 338(6106): 524-528.
【2】Hanne J, Gottfert F, Schimer J, et al. Stimulated Emission Depletion Nanoscopy Reveals Time-Course of Human Immunodeficiency Virus Proteolytic Maturation[J]. ACS Nano, 2016, 10(9): 8215-8222.
【3】Wang IH, Suomalainen M, Andriasyan V, et al. Tracking viral genomes in host cells at single-molecule resolution. Cell Host Microbe. 2013;14(4):468–480.
【4】Li Z, Fang C, Su Y, et al. Visualizing the replicating HSV-1 virus using STED super-resolution microscopy[J]. Virology Journal, 2016, 13(1): 65-65.
【5】Mehedi M, Mccarty T, Martin S E, et al. Actin-Related Protein 2 (ARP2) and Virus-Induced Filopodia Facilitate Human Respiratory Syncytial Virus Spread[J]. PLOS Pathogens, 2016, 12(12).

